Genomica dei tumori e terapie anticancro mirate
Introduzione
Genomica dei tumori e terapie anticancro mirate è un programma di ricerca IFOM coordinato da Alberto Bardelli e dedicato allo studio delle differenze genetiche nei tumori e delle opportunità di cura che possono derivare da questa complessità.
Tanto storica quanto quella del sequenziamento del genoma umano, l'impresa di sequenziare i genomi tumorali ha raggiunto una fase avanzata, rivelando informazioni fondamentali per la medicina.
È ormai noto che i geni che si ritrovano più frequentemente coinvolti nel cancro, quelli che una volta mutati spingono con forza la cellula alla trasformazione tumorale, sono un numero ristretto. Tuttavia, esistono geni che, seppur raramente mutati, possono comunque guidare la crescita tumorale. Oltre questa complessità, la varietà di modi in cui mutazioni distinte possono combinarsi, tra loro e con assetti normali, contribuisce nel dare origine a tumori eterogenei, sia all’interno dello stesso tipo di malattia (es. i tumori del colon non sono tutti uguali) che nella medesima persona (e addirittura nella stessa massa tumorale).
Le implicazioni cliniche di questa eterogeneità sono rilevantissime.
Tumori apparentemente simili all'esame istologico del tessuto malato, e per questo trattati alla stessa maniera, possono in realtà rivelarsi entità dissimili da un punto di vista molecolare, e per questo rispondere in modo differente alle terapie e presentare esiti clinici differenti.
In un contesto sempre più orientato alla medicina di precisione, quindi, il profilo genetico del tumore diviene un elemento essenziale e strategico per la cura personalizzata di ogni paziente.
Alberto Bardelli e il suo team, con il programma Genomica dei tumori e terapie anticancro mirate con sede congiunta in IFOM e all’Università di Torino, si impegnano da oltre 15 anni nello studio genomico dei tumori solidi.
In particolare, il tumore del colon-retto, fra i primi per incidenza e mortalità in Italia e nel mondo, costituisce il centro delle ricerche del laboratorio, volte a:
- Analizzare il profilo genetico delle cellule tumorali;
- Seguirne l'evoluzione durante il corso della malattia, nelle sue diverse fasi e in seguito ai trattamenti;
- Comprendere come il profilo genetico del tumore influenzi la risposta ai trattamenti farmacologici, per guidare di conseguenza la migliore scelta terapeutica a livello del singolo paziente;
- Studiare la connessione fra mutazioni del DNA, la generazione di neoantigeni (proteine alterate a seguito delle mutazioni) e il riconoscimento del tumore da parte del sistema immunitario, con l’obiettivo di comprendere se e come questo possa essere modulato.
L'Ambito Biologico
Il programma di ricerca IFOM Genomica dei tumori e terapie anticancro mirate studia i tumori solidi e in particolare quelli colon-rettali per capire in che modo il loro quadro genetico influenzi la risposta del tumore ai trattamenti mirati, per migliorarne la personalizzazione di cura.
Il cancro è essenzialmente una malattia del genoma. È qui nel genoma, infatti, che possono accumularsi, nel corso della vita di una persona, le mutazioni che trasformano le sue cellule da normali in maligne.
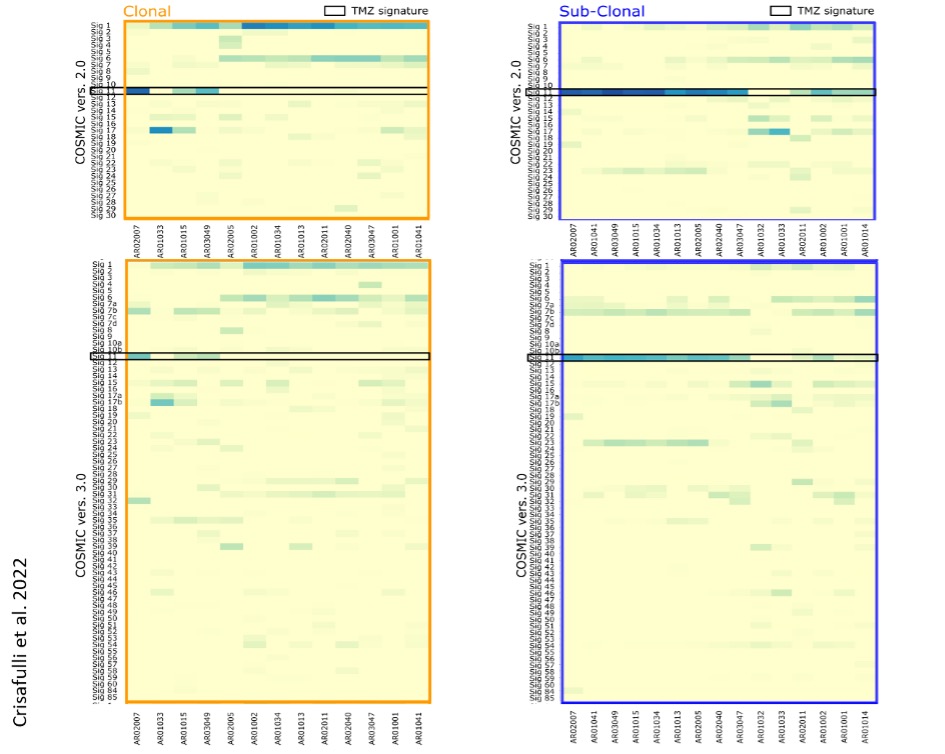
Il cancro è essenzialmente una malattia del genoma.
È qui nel genoma, infatti, che possono accumularsi, nel corso della vita di una persona, le mutazioni che trasformano le sue cellule da normali in maligne.
È sempre nel genoma - nella combinazione particolare di alterazioni genetiche che il DNA sviluppa durante la trasformazione e la progressione tumorale - sta ciò che può rendere tanto diverse due forme distinte di cancro quanto due cellule maligne dello stesso tumore, in seguito alle moltiplicazioni cellulari incontrollate che accrescono la sua massa.
Nel genoma tumorale, quindi, si trovano tracce importanti per comprendere meglio la biologia del cancro, tratti caratteristici per riconoscerne con precisione le diverse forme e per prevederne il decorso clinico, come anche elementi per individuare bersagli specifici, sui quali progettare farmaci su misura che agiscano in modo mirato e non più indiscriminato.
Diversi farmaci innovativi hanno dimostrato di poter cambiare radicalmente le prospettive di cura di diversi tipi tumorali, fra cui il tumore del colon-retto.
Il successo di questo approccio, però, dipende non solo dalla presenza del suo bersaglio nel tumore, ma anche dal contesto genetico in cui si trova ad agire e che può contribuire a far emergere, perché quest’ultimi potrebbero influenzare la risposta delle cellule malate al trattamento (concetto di resistenza alla terapia, primaria o acquisita).
Un esempio emblematico è quello dei farmaci che prendono di mira il recettore per il fattore di crescita epidermico (EGFR), diffusamente espresso nelle cellule di tumore del colon-retto. Alberto Bardelli e il suo gruppo sono stati fra i primi a studiare il genoma al fine di valutare la sua influenza sulla risposta alla terapia anti-EGFR.
In questi tumori, come in molti altri, EGFR è responsabile dell'accensione di cascate di segnali che spingono le cellule maligne alla proliferazione incontrollata, con la formazione di vasi sanguigni dedicati alle esigenze tumorali e l’invasione di altri organi e tessuti.
Le terapie anti-EGFR, utilizzate frequentemente in una porzione dei tumori colo-rettali in stadio metastatico, possono spegnere questo segnale e neutralizzare la crescita tumorale. Tuttavia, poiché EGFR rappresenta solo uno degli ingranaggi del complesso meccanismo da cui dipendono le proprietà maligne di questi tumori, è elevata la probabilità che altri geni a valle, stravolti da mutazioni, permettano di aggirare una sua eventuale inattivazione farmacologica, annullando così i benefici del trattamento. È altresì possibile (e frequente) che tali mutazioni di resistenza, inizialmente non presenti o presenti solo in una minima quota di cellule eterogenee, emergano sotto la pressione della terapia, condizionando l’insorgere della resistenza dopo un iniziale beneficio. Infine, anche in assenza di mutazioni acquisite, le cellule tumorali possono acquisire uno stato di quiescenza e persistenza (definito da noi e altri gruppi come stato di cellule persister) che consente loro di sopravvivere al trattamento, mediante modulazione dinamica di specifici pattern di espressione genica.
Grazie agli studi su EGFR oggi sappiamo che la stessa via di segnalazione, in pazienti diversi, ma anche in cellule tumorali differenti appartenenti allo stesso paziente, potrebbe mediare la sensibilità del tumore al farmaco o la sua capacità di resistergli.
Allo stesso modo, anche il sistema immunitario può essere influenzato nella sua attività di sorveglianza contro le cellule tumorali, in primis dalle stesse caratteristiche genetiche del tumore. Anche questo ambito è oggetto intensivo di studio del laboratorio.
Una percentuale limitata di tumori del colon-retto (tumori caldi MSI), infatti, si genera e progredisce sulla spinta di difetti congeniti o acquisiti della capacità di riparo del danno al DNA. Queste cellule, incapaci di conservare il loro genoma, acquisiscono inevitabilmente un elevato carico di mutazioni, che a loro volta generano proteine alterate (neoantigeni) e permettono al sistema immunitario un chiaro riconoscimento della loro natura abnorme. Una volta ingaggiato, il sistema immunitario si rivela un’efficace arma antitumorale con probabilità di successo uguali se non superiori a quelle delle terapie farmacologiche.
Gli obiettivi del programma
Molto di quello che oggi si conosce su sensibilità e resistenze dei tumori metastatici colon-rettali ai farmaci a bersaglio molecolare, di cui EGFR fu capostipite seguito da HER2 e numerosi altri geni, si deve agli studi condotti da Alberto Bardelli e dalla sua équipe.
Molto ancora, però, rimane da indagare per sviluppare strategie che permettano di superare gli ostacoli che incontrano le terapie a bersaglio molecolare e ottimizzare i trattamenti per i tumori solidi.
Oltre ad analizzare i quadri genetici dei tumori e trovare correlazioni, chiamate farmacogenomiche, tra profilo di attività dei farmaci e profilo genetico delle cellule maligne, il programma di ricerca IFOM Genomica dei tumori e terapie anticancro mirate è impegnato nell’inquadramento della relazione fra genoma e le cosiddette omiche (lo studio delle diverse molecole che derivano dalla trascrizione del genoma e che interagiscono con esso) – trascrittomica, metilomica, proteomica, metabolomica, etc. Questo significa indagare a fondo le basi molecolari del cancro e della resistenza ai diversi trattamenti, con focus sui suoi meccanismi di insorgenza.
L’importanza di identificare i meccanismi di resistenza farmacologica risiede nella conseguente possibilità di prevenirli, ad esempio tramite la co-somministrazione di molecole (doppio blocco). È il caso della terapia anti-HER2, studiata dal gruppo di Alberto Bardelli in un gruppo multidisciplinare di scienziati e medici, che necessita di questo tipo di approccio per indurre una regressione tumorale nei tumori del colon-retto con elevata dipendenza da HER2. Oppure della terapia anti-BRAF, un altro importante gene del cancro, verso cui il gruppo ha contribuito alla dissezione dei meccanismi molecolari di resistenza fino alla comprensione della necessità di applicare trattamenti di doppio blocco per ottenere una risposta tumorale.
In sintesi, il fine ultimo degli studi condotti dallo scienziato è fornire strumenti efficaci per identificare meglio e prima le vulnerabilità molecolari dei diversi tumori solidi, in primis a partenza dal colon o dal retto, e determinare in base alle caratteristiche genetiche la giusta sequenza o combinazione di terapie da utilizzare nel trattamento personalizzato, superando così le limitazioni delle strategie terapeutiche correnti.
Gli approcci
L'unità di ricerca impegnata nel programma Genomica dei tumori e terapie anticancro mirate utilizza nei suoi studi diversi approcci di genetica molecolare e biologia cellulare. Inoltre, in continuità con la visione di IFOM affinché i progressi scientifici siano indirizzati a produrre benefici concreti per i pazienti, il gruppo è impegnato nell’ambito di numerosi studi clinici di rilevanza internazionale, a contribuisce con l’analisi genomica e omica dei campioni dei pazienti fino alla generazione di nuove ipotesi terapeutiche da sperimentare.
L'impiego di modelli cellulari di cancro che ripropongono gli stessi tratti molecolari mostrati nell'organismo dai tumori di interesse, e la possibilità di derivarli dagli stessi campioni umani, permettono di studiare in dettaglio diversi aspetti della biologia tumorale, come i segnali che spingono la proliferazione incontrollata, e di valutare in questi contesti l'efficacia di diverse terapie anticancro (fra cui anche le terapie a bersaglio molecolare e l’immunoterapia). Si può dire che tali modelli permettano infatti la generazione di avatar su cui diviene possibile sperimentare diversi tipi di trattamento per individuare le migliori opzioni terapeutiche a livello paziente-specifico.
I profili genetici e molecolari dei pazienti, invece, vengono ricostruiti impiegando alcune tra le più avanzate tecnologie per lo studio dei genomi, in particolare la metodica di sequenziamento del DNA di ultima generazione (next generation sequencing o NGS) che permette di sequenziare l'intero genoma in brevissimo tempo.
Se fino a qualche tempo fa era possibile condurre questo genere di studi solo su campioni di tessuto malato prelevati dal paziente utilizzando metodi invasivi come la biopsia, oggi anche il sangue (e altri fluidi corporei facilmente accessibili come le urine) possono essere utilizzati al medesimo scopo.
Alberto Bardelli e il suo team sono pionieri nello sviluppo della cosiddetta biopsia liquida, che permette di ottenere da un semplice prelievo di sangue (non invasivo) lo stesso tipo di informazioni complesse che deriverebbero dall’analisi del tessuto tumorale. La tecnologia analizza infatti i frammenti di DNA che vengono rilasciati dal tumore nel torrente ematico. In questo modo è possibile monitorare più facilmente ed efficacemente l'evoluzione dei profili genetici delle cellule maligne e della malattia in seguito ai trattamenti, nonché sintetizzarne meglio la complessità e l’eterogeneità, come dimostrato dallo scienziato nel caso dei tumori colon-rettali.
L'aspetto clinico, le ricerche effettuate su campioni provenienti dai pazienti e la collaborazione con gli oncologi medici sono l'elemento caratterizzante di questo programma. Lo scambio e il confronto continuo tra biologi, genetisti e medici garantisce un approccio multidisciplinare al problema cancro, fondamentale per affrontarne la complessità e per trasferire il più rapidamente possibile alla pratica clinica le conoscenze acquisite con la ricerca.
Impatto su diagnosi, prevenzione o trattamento dei tumori
I risultati del gruppo Genomica dei tumori e terapie anticancro mirate hanno rivelato come anche tumori molto simili dal punto di vista dell’origine e dell’istologia (morfologia, caratteristiche anatomopatologiche, etc.) possono celare una notevole eterogeneità dal punto di vista molecolare, che si traduce in variazioni negli esiti della malattia e in una diversa risposta ai trattamenti farmacologici, anche i più mirati, da paziente a paziente.
La possibilità di sviluppare strategie di cura che intervengano con precisione sulla base delle caratteristiche biologiche del tumore, quindi, si basa sull’esito degli studi genomici e molecolari, su cui è impegnato il gruppo di Alberto Bardelli.
Un esempio di quello che viene considerato oggi un passo avanti nella direzione della medicina personalizzata riguarda proprio il trattamento dei tumori del colon-retto.
Fino a 15 anni fa i pazienti con metastasi di questo tumore venivano trattati con farmaci mirati contro EGFR, ritenuti fra i più efficaci, ma solo un 10-20% di essi ne beneficiava. Grazie agli studi del gruppo di Alberto Bardelli, oggi sappiamo il perché.
In una larga parte dei tumori del colon-retto sono presenti alterazioni molecolari (le più frequenti delle quali sono le mutazioni in KRAS e BRAF) che impediscono la risposta alle terapie anti-EGFR. Questa scoperta, entrata nella storia dell’oncologia per aver cambiato la pratica clinica, ha permesso di migliorare la selezione dei pazienti verso questo tipo di trattamento, aumentando le probabilità di risposta in coloro che lo ricevono, e risparmiando tossicità inutili nei casi di resistenza prevedibile.
Grazie anche al lavoro di Bardelli, inoltre, si sa che quando emergono cellule maligne resistenti in seguito al trattamento - per la selezione di mutazioni di resistenza -, il tumore smette di rispondere alla cura poiché capace di sfuggire al blocco del farmaco. Queste mutazioni sono state monitorate dai ricercatori in modo non invasivo nel sangue dei pazienti dopo il trattamento, scoprendone la natura dinamica. Ovvero, dopo un certo tempo dalla loro comparsa, è infatti possibile che le mutazioni di resistenza siano contro-selezionate dalle nuove terapie somministrate, scomparendo, e rendendo nuovamente sensibile il tumore a un rechallenge (ritrattamento) con farmaci a bersaglio molecolare.
Nell’interesse dei pazienti, questa osservazione è stata convogliata immediatamente in uno studio clinico che ha dimostrato come tramite la biopsia liquida sia possibile definire il miglior momento per il rechallenge anti-EGFR.
Allo stesso modo la biopsia liquida è stata applicata ad altri importanti studi clinici recenti del gruppo sul tumore del colon-retto: ad esempio, al monitoraggio della trasformazione farmaco-indotta di tumori freddi in tumori caldi, per informare la possibilità di somministrare immunoterapia in situazioni di partenza di non sensibilità (la maggior parte dei tumori del colon-retto non è infatti sensibile all’immunoterapia); oppure, ricerca di cellule tumorali residue ma non visibili alle indagini convenzionali dopo l’intervento chirurgico, per definire la probabilità di recidiva e intervenire farmacologicamente modulando l’intensità dei trattamenti chemioterapici post-chirurgici.
Queste e altre conoscenze prodotte attraverso il programma di ricerca IFOM Genomica dei tumori e terapie anticancro mirate coordinato da Alberto Bardelli, trasferite alla pratica clinica, hanno l’obiettivo di contribuire in maniera significativa a migliorare la diagnostica e il trattamento dei pazienti affetti da tumori solidi.