Meccanismi di migrazione delle cellule tumorali
La fisiopatologia della fluidificazione dei tessuti
Le prime fasi della carcinogenesi sono i processi attraverso i quali la neoplasia epiteliale evolve progressivamente in un tumore invasivo. Questi processi sono associati all'acquisizione di motilità cellulare e all'alterazione dell'organizzazione e della dinamica delle cellule e dei tessuti, favorita dal passaggio meccanico da uno stato solido a uno liquido (Giavazzi et al., 2018; Kai et al., 2016; Malinverno et al., 2017; Oswald et al., 2017; Palamidessi et al., 2019 ). Come i materiali morbidi inerti, come le schiume e i colloidi, i tessuti epiteliali normali e maligni possono subire una transizione di fase da solido a fluido, che consente loro di fluire e di riorganizzare i loro costituenti, pur mantenendo l'integrità meccanica complessiva. Durante lo sviluppo di un organo, i tessuti epiteliali normali si evolvono spesso in masse solide, densamente popolate di cellule. Si ritiene che ciò garantisca il corretto sviluppo delle proprietà di barriera e dell'elasticità del tessuto e agisca come meccanismo di soppressione tumorale per la crescita e l'espansione di singole varianti oncogeniche. Per riparare una ferita, rigenerarsi o diventare maligno, è necessario un certo grado di fluidità affinché un tessuto possa proliferare, migrare e disseminare. Un processo recentemente scoperto per spiegare questo comportamento è il "cell unjamming", una transizione di fase in cui i tessuti si muovono in modo coordinato e cooperativo come fossero dei fluidi che scorrono (Ilina et al., 2020; Malinverno et al., 2017; Mitchel et al., 2020; Oswald et al., 2017; Palamidessi et al., 2019; Park et al., 2016; Park et al., 2015; Tetley et al., 2019 ).
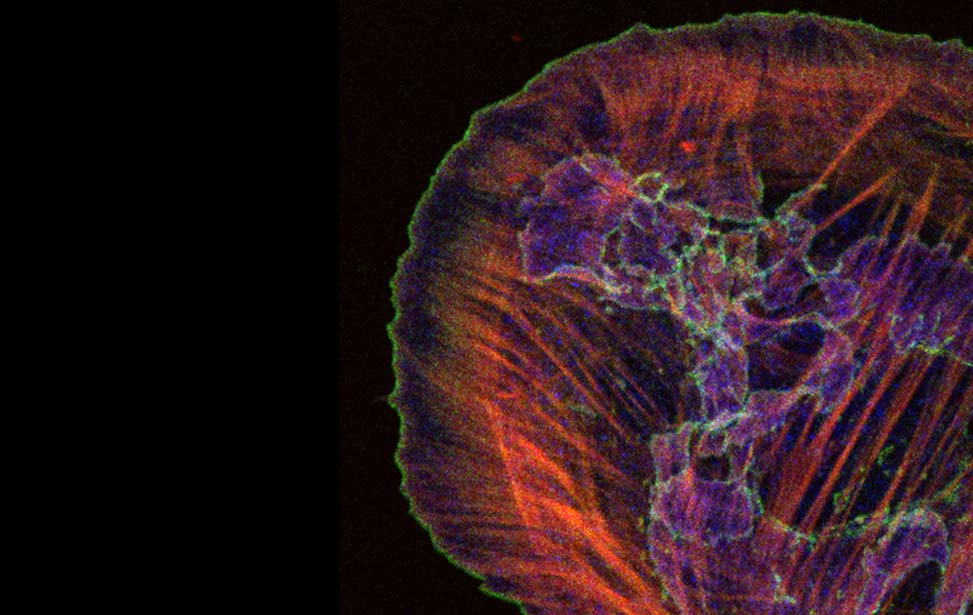
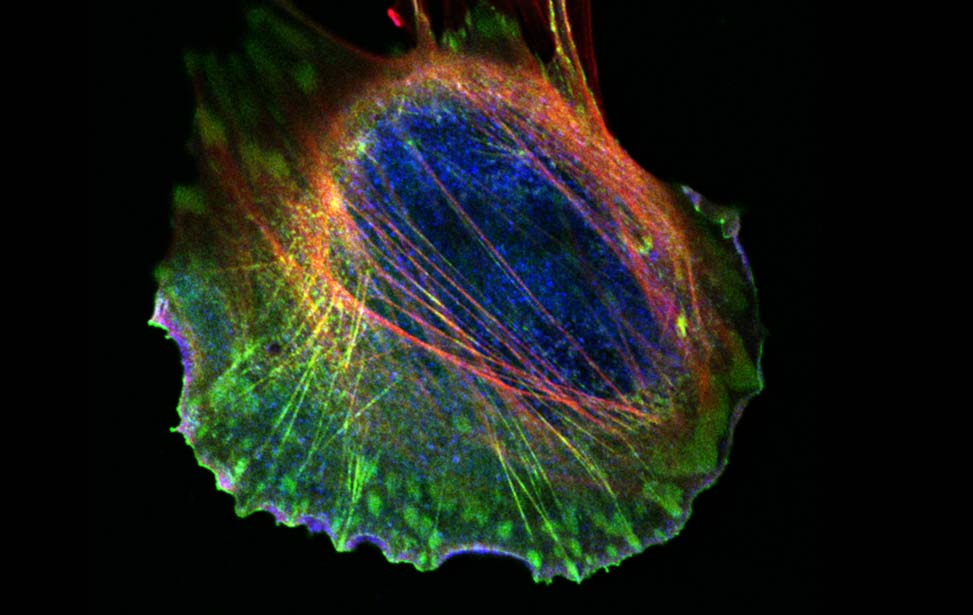
Pannelli superiori: analisi dell'evoluzione dinamica dei monostrati epiteliali mammari, che ad una densità critica vanno incontro una transizione di fase da fluido a solido
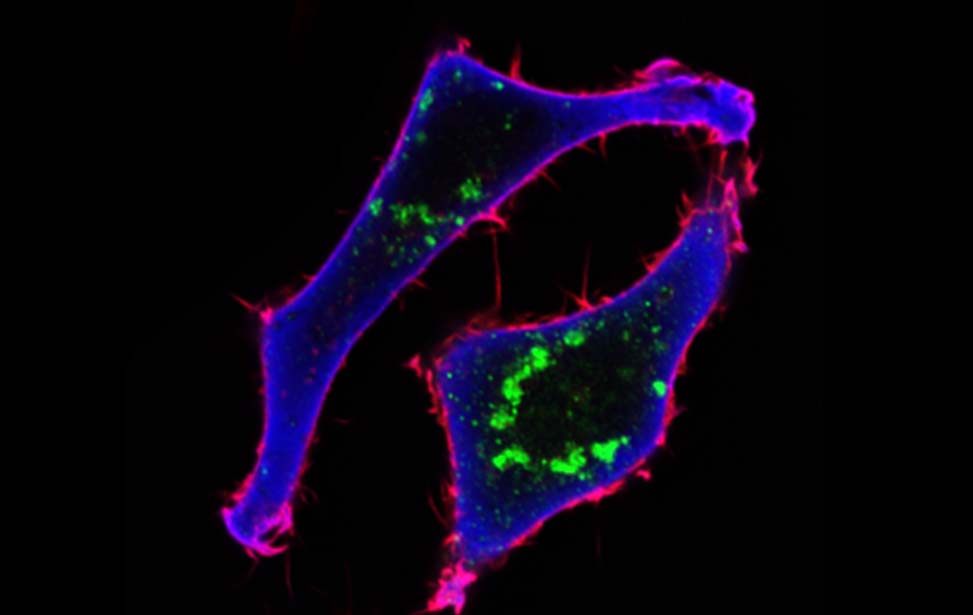
Pannelli centrali: Rab5A induce una transizione verso uno stato fluido che si traduce in una rotazione persistente di sferoidi tumorali in 3D
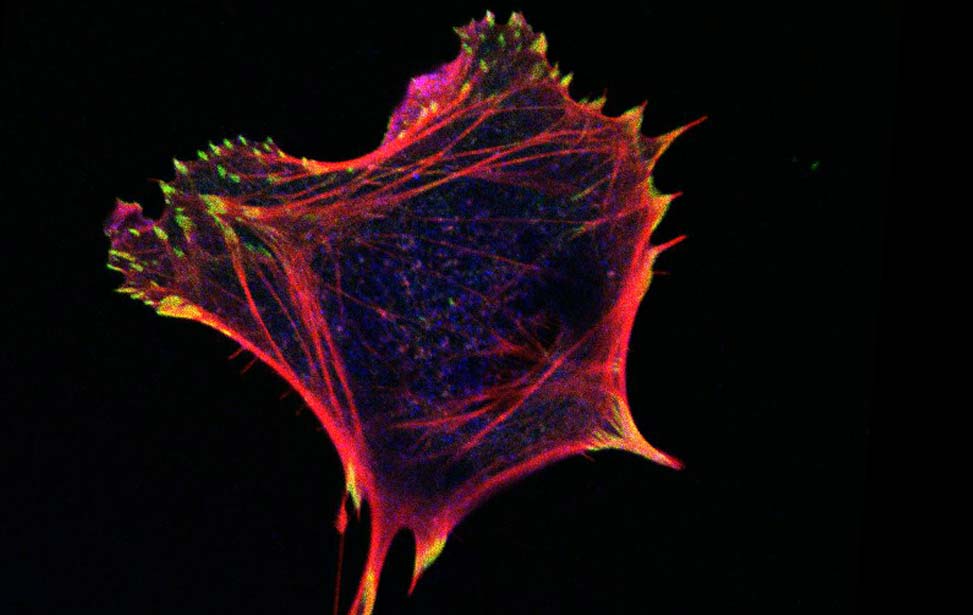
Pannello inferiore: della forma nel carcinoma duttale in situ sono alla base della transizione da uno stato solido e 'jammed' (a sinistra) a uno stato fluido e 'unjammed' (a destra).
Un caso esemplare in cui si osserva questo tipo di transizione di fase è nella progressione dell'adeno-carcinoma duttale in situ (DCIS), un precursore del cancro al seno, in carcinoma duttale invasivo (IDC). Recentemente, abbiamo caratterizzato una strategia, endocitica-dipendente, di motilità collettiva, di disseminazione delle cellule da solido a liquido o di transizione senza contatto attraverso il flocking, che è coinvolta nella progressione da DCIS a IDC nel cancro al seno umano (Atia et al., 2018; Kuriyama et al., 2014; Malinverno et al., 2017; Palamidessi et al., 2019; Park et al., 2015 ). In particolare, abbiamo dimostrato che RAB5A, un regolatore principale dell'endocitosi la cui espressione è elevata nel carcinoma mammario umano aggressivo e correla con una ridotta sopravvivenza libera da recidiva delle pazienti (Frittoli et al., 2014 ), è sufficiente a risvegliare, attraverso la fluidificazione dei tessuti, la motilità collettiva dei carcinoma intra-duttali in situ, promuovendone l’invasione e disseminazione Questo fenomeno è accompagnato anche da un cambio di identità trascrizionale con l’attivazione di una risposta immunitaria innata cGAS/STING-dipendente che influenza il destino e il comportamento delle lesioni tumorali. Complessivamente, queste evidenze indicano che la fluidificazione tessutale una via alternativa o meglio complementare verso la migrazione ed invasione cellulare. Questa transizione di carattere meccanico si accompagna ad una alterazione trascrizionalmente che cambia la natura del tessuto tumorale verso forme aggressive. Tuttavia, questi stessi cambiamenti possono anche innescare una risposta immunitaria antitumorale e come tali rendere le stesse lesioni più aggredibile dal Sistema immunitario. I meccanismi e il ruolo fisiopatologico della fluidificazione del tessuto epiteliale durante la progressione del carcinoma mammario sollevano diverse domande e questioni irrisolte, che intendiamo affrontare attraverso una combinazione di approcci fisici, biofisici e di biologia delle cellule tumorali.
Le domande specifiche a cui vorremmo dare risposte sono:
- Quali sono i meccanismi fisici e molecolari che controllano la fluidificazione dei tessuti nelle cellule epiteliali e nei modelli di tumore al seno DCIS?
- In che modo le perturbazioni meccaniche associate all'unjamming, impattando l'acquisizione di cambiamenti ereditabili, influenzano i fenotipi cellulari, il destino e l'ecologia tumorale (interazione delle cellule tumorali con le cellule immunitarie). Ci concentreremo in particolare sui processi cellulari inaspettati e sui meccanismi molecolari che mediano le alterazioni trascrizionali dipendenti dalla fluidificazione dei tessuti verso una risposta di immunità innata mediata da cGAS-STING, studiando il ruolo della dinamica, della morfologia e dell'integrità dei mitocondri.
- Quali sono le conseguenze patofisiologiche della fluidificazione tissutale, ed in particolare intendiamo capire se la fluidificazione tissutale può trasformare lesioni immunologiche fredde in lesioni calde, in modelli di topi singenici e campioni umani.
Shape & Cell Fate
Parallelamente al programma descritto sopra, ci è stato recentemente assegnato un ERC-synergy-grant, ShapinCellFate, insieme a Matthieu Piel (CNRS, Parigi, Francia), Raphaël Voituriez (CNRS, Parigi, Francia) e Ana-Maria Lennon-Duménil (INSERM, Parigi, Francia). L'obiettivo generale della proposta è quello di mettere in relazione la storia dei cambiamenti di forma delle cellule con il comportamento e il destino sia di cellule dendritiche che del cancro al seno. Brevemente: Le cellule sono spesso rappresentate come oggetti sferici irregolari - la forma che adottano in sospensione. Tuttavia, l'ambiente compatto dei tessuti altera questa forma semplice, causando grandi deformazioni cellulari. Ciò si verifica durante la normale crescita dei tessuti ed è ancora più pronunciato quando il tessuto cresce eccessivamente, come nel caso dei tumori solidi. I cambiamenti di forma delle cellule si verificano spesso nelle cellule migratorie, come le cellule immunitarie che pattugliano l'organismo all'interno dei tessuti interstiziali e le metastasi tumorali che sfuggono al tumore primario per invadere i tessuti sani. In tutti questi casi, le cellule si adattano e sopravvivono a deformazioni anche molto grandi. I meccanismi alla base di questa risposta e le conseguenze a lungo termine che i ripetuti cambiamenti di forma delle cellule hanno sulla fisiologia e sulla patologia rimangono in gran parte sconosciuti. Abbiamo osservato che i cambiamenti di forma delle cellule e degli organelli inducono modifiche reversibili e irreversibili nel loro comportamento e nelle loro funzioni. Ipotizziamo che le cellule utilizzino tali meccanismi per integrare le deformazioni successive, di ampiezza e durata diverse, che subiscono nel corso della loro vita. Ciò implica l'esistenza di "effetti di memoria indotti dalla forma cellulare che cambia" che non solo codificano la storia geometrica e meccanica della cellula, ma ne dettano anche il destino. Ci proponiamo di definire i meccanismi molecolari e i principi fisici alla base degli effetti di memoria indotti dalle variazioni di forma e di valutare il loro impatto sull'immunità e sul cancro. Ci concentreremo su due tipi di cellule che subiscono grandi cambiamenti di forma in vivo e interagisco nel contesto della progressione tumorale: (1) le cellule dendritiche, che avviano risposte immunitarie adattative, e (2) le cellule tumorali derivate dagli epiteli mammari.