News e Comunicati stampa
Carcinoma mammario: individuato un fattore molecolare alla base della metastatizzazione
2019.07.22
Un gruppo di ricercatori dell’IFOM e dell’Università degli Studi di Milano ha individuato un meccanismo molecolare che rende invasivo e "fluido" il carcinoma intraduttale mammario, uno dei tumori più diffusi. I risultati dello studio sostenuto da AIRC sono stati pubblicati sulla rivista scientifica Nature Materials. L’obiettivo della ricerca, per cui gli scienziati hanno utilizzato modelli sperimentali innovativi come gli sferoidi tumorali, è contribuire a individuare terapie più mirate.
Milano, 22 luglio 2019 - I tessuti del nostro corpo sono in grado di passare da uno stato più solido a uno più fluido e viceversa, un po’ come può accadere alla sabbia contenuta in una clessidra, che può scorrere liberamente oppure bloccarsi e formare un tappo solido, per riprendere poi a fluire in seguito ad una azione esterna. Tale abilità è funzionale, ad esempio, alla riparazione delle ferite e all’allungamento del corpo durante la crescita.
La capacità di passare da uno stato più solido a uno più fluido influenza altresì fortemente lo sviluppo e la diffusione di tumori. Infatti un tessuto, quando è completamente solido, diventa immobile e refrattario allo sviluppo di tumori o alla loro metastatizzazione; viceversa, la fluidificazione ne facilita la plasticità e il movimento, e può essere sfruttata dalle cellule tumorali che possono così invadere altre parti dell’organismo. Come le cellule tumorali siano in grado di controllare questa transizione di stato e comportarsi come 'materiali intelligenti' che si adattano e sfruttano le caratteristiche fisiche dell’ambiente in cui proliferano non è ancora chiaro.
Grazie all’integrazione tra biologia molecolare e fisica dei materiali, un gruppo di scienziati dell’IFOM e dell’Università degli Studi di Milano ha individuato i meccanismi molecolari alla base dell’acquisizione di proprietà invasive da parte del carcinoma intraduttale mammario (Ductal Carcinoma In Situ, DCIS). Questo tipo di carcinoma è tra i tumori più diffusi (20% delle diagnosi di carcinoma) ed è caratterizzato dall’insorgenza di lesioni primarie all’interno del dotto mammario, dove la forte compressione da parte del tessuto esterno le “impacca ed immobilizza”. Di tutti i carcinomi intraduttali mammari, circa il 70% rimane indolente, cioè non è in grado di formare metastasi, mentre il restante 30% sviluppa caratteristiche “fluide” che permettono al tumore di superare i confini che lo limitano e di invadere.
“Questa caratteristica – spiega il professor Scita, capo dell’unità di ricerca ‘Meccanismi di ricerca delle cellule tumorali’ di IFOM e professore ordinario di Patologia Generale presso la Facoltà di Medicina dell'Università degli Studi di Milano – rende questo tipo di tumore un modello ideale per studiare la relazione tra transizione di stato e il potenziale di metastatizzazione. Due anni fa – prosegue Scita – avevamo constatato come RAB5A, una proteina che regola la capacità delle cellule di internalizzare membrane e recettori, fosse sorprendentemente capace di indurre la fluidificazione di un tessuto di cellule epiteliali dense e impaccate. L’azione ricorda quella di un vigile che riesce a rendere scorrevole il traffico congestionato delle nostre citta. Ciò che emerge oggi dai nostri laboratori è che questa motilità, osservata in un modello di tumore particolarmente sensibile a questo fattore, quale il carcinoma intraduttale mammario, è anche associata alla capacità del tumore di modificare la matrice extracellulare e invadere il tessuto circostante.
“Abbiamo ingegnerizzato cellule di ghiandola mammaria in modo da elevare il livello della proteina Rab5A, che è tipicamente molto espressa nei tumori più aggressivi della mammella – spiegano Andrea Palamidessi, Chiara Malinverno e Emanuela Frittoli, i primi autori dell’articolo –. Quindi abbiamo osservato che questa semplice manipolazione è sufficiente a risvegliare la motilità di una popolazione cellulare andata incontro a solidificazione e a permettere l’acquisizione di movimenti collettivi fluidi e scorrevoli”.
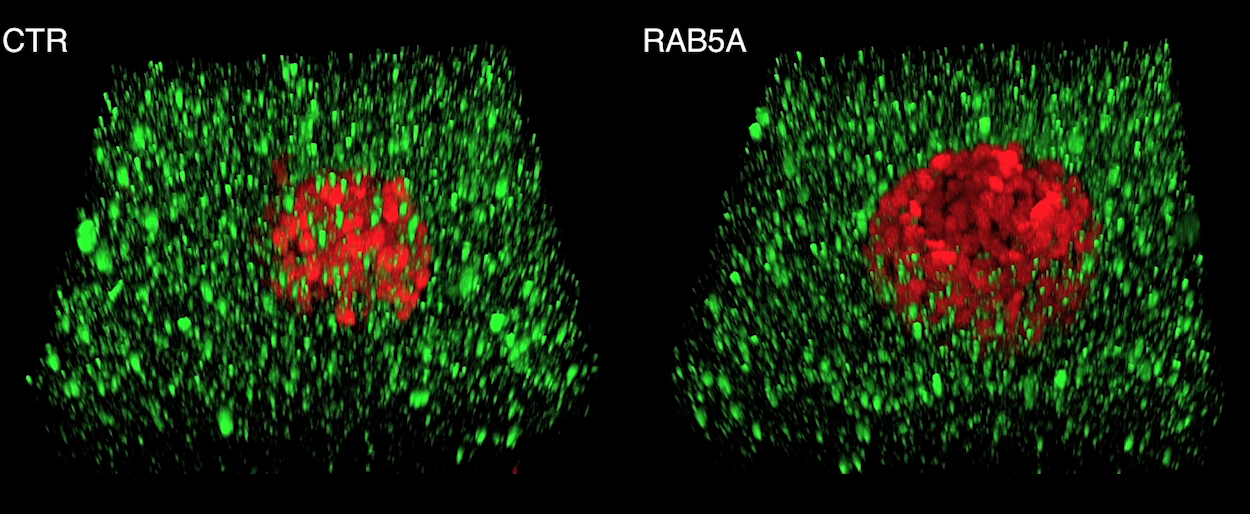
 Solo gli sferoidi di carcinoma mammario che esprimo RAB5A acquisiscono properietà fluide, ruotano persistentemente ed invadono collettivamente. Per poterli visualizzare gli sferoidi sono stati ingegnerizzati per esprimere proteine fluorescenti rosse ( nucleo) e verdi (citoscheletro).
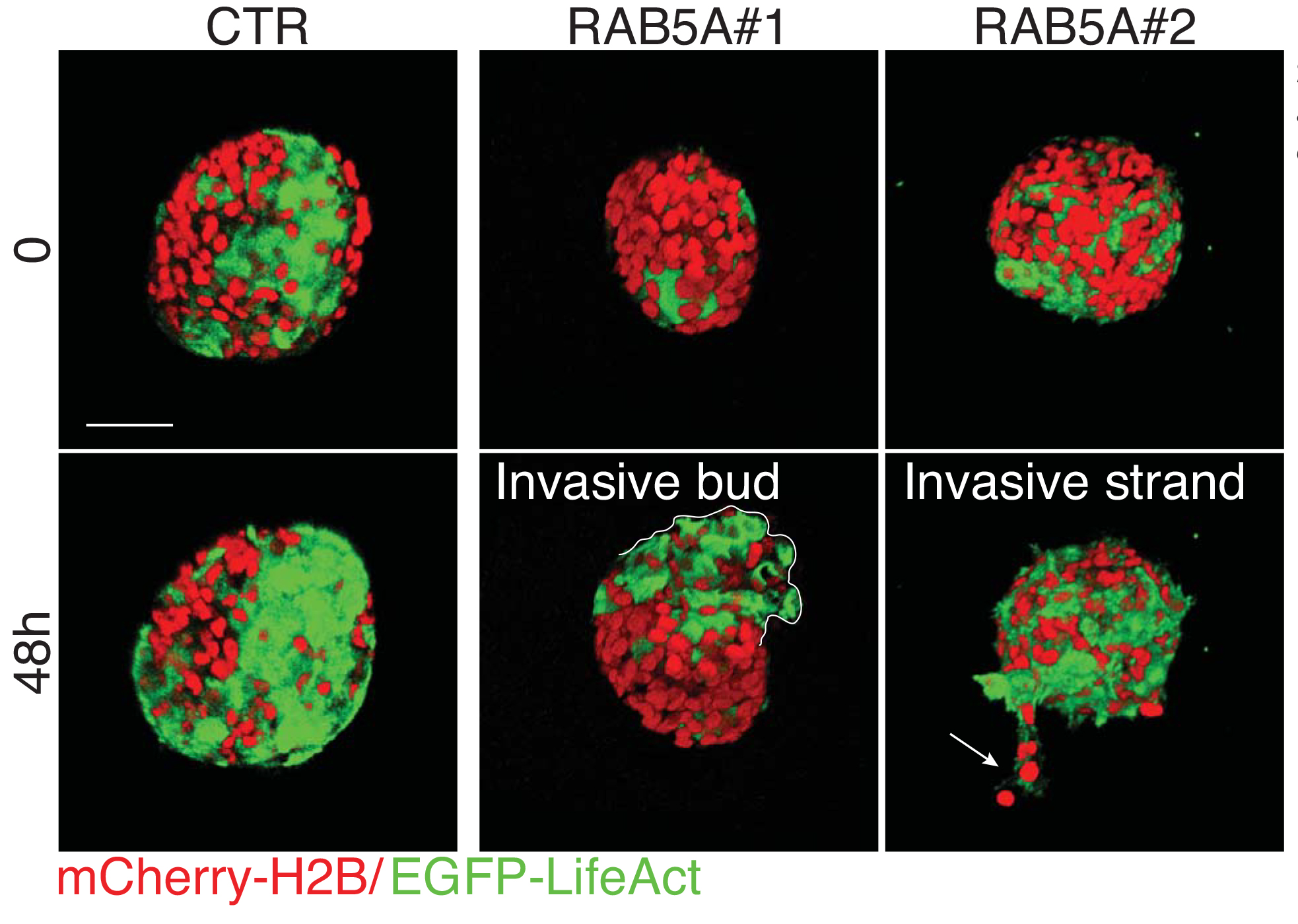
Solo gli sferoidi di carcinoma mammario che esprimo RAB5A acquisiscono properietà fluide, ruotano persistentemente ed invadono collettivamente. Per poterli visualizzare gli sferoidi sono stati ingegnerizzati per esprimere proteine fluorescenti rosse ( nucleo) e verdi (citoscheletro).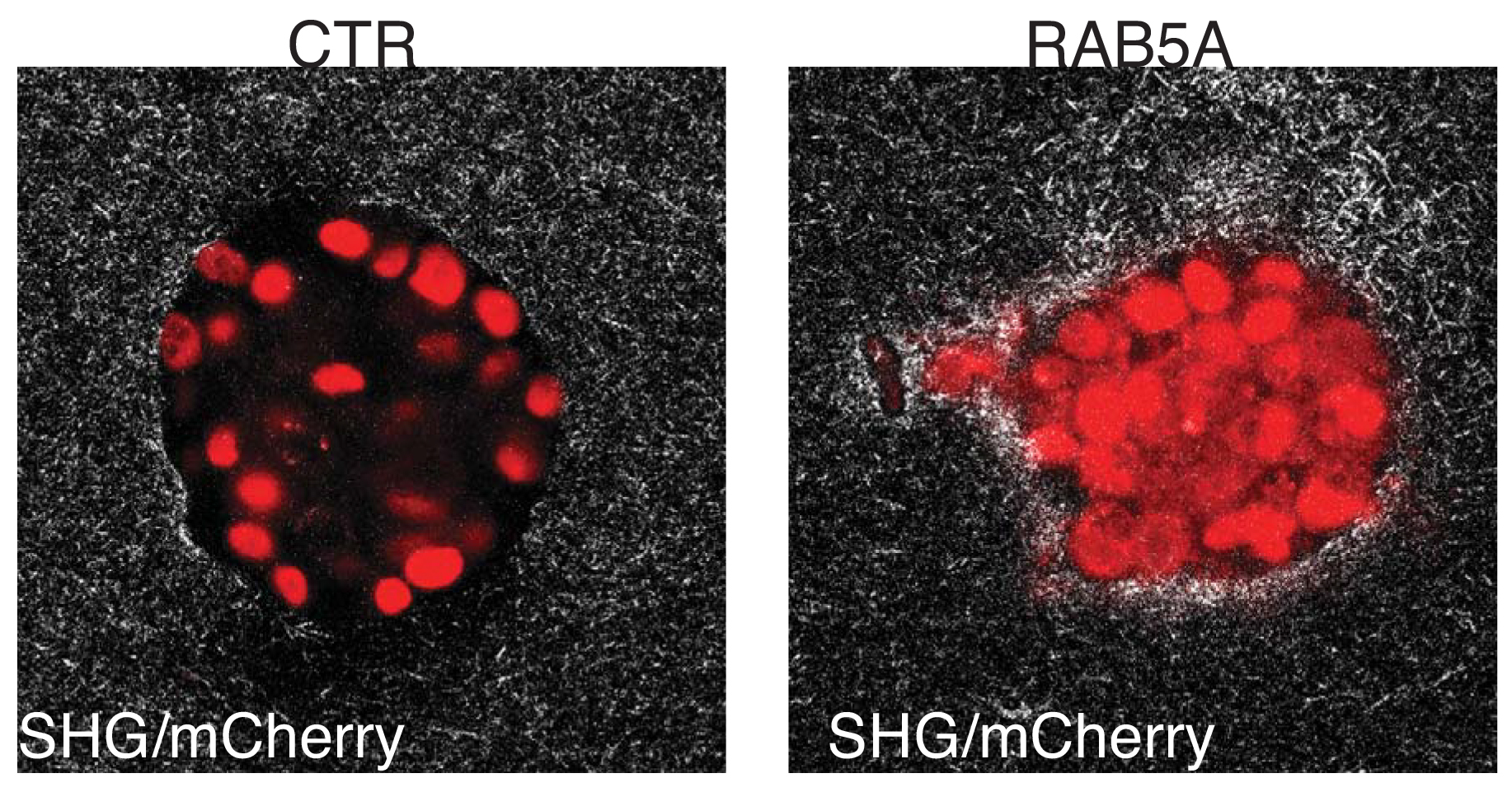 Solo gli sferoidi di carcinoma mammario che esprimono RAB5A alterano la matrice extracellulare, formando canali e varchi in cui i tumori fluidi possono invadere i tessuti. Visualizzazione tramite microscopio a 2 fotoni.
Solo gli sferoidi di carcinoma mammario che esprimono RAB5A alterano la matrice extracellulare, formando canali e varchi in cui i tumori fluidi possono invadere i tessuti. Visualizzazione tramite microscopio a 2 fotoni.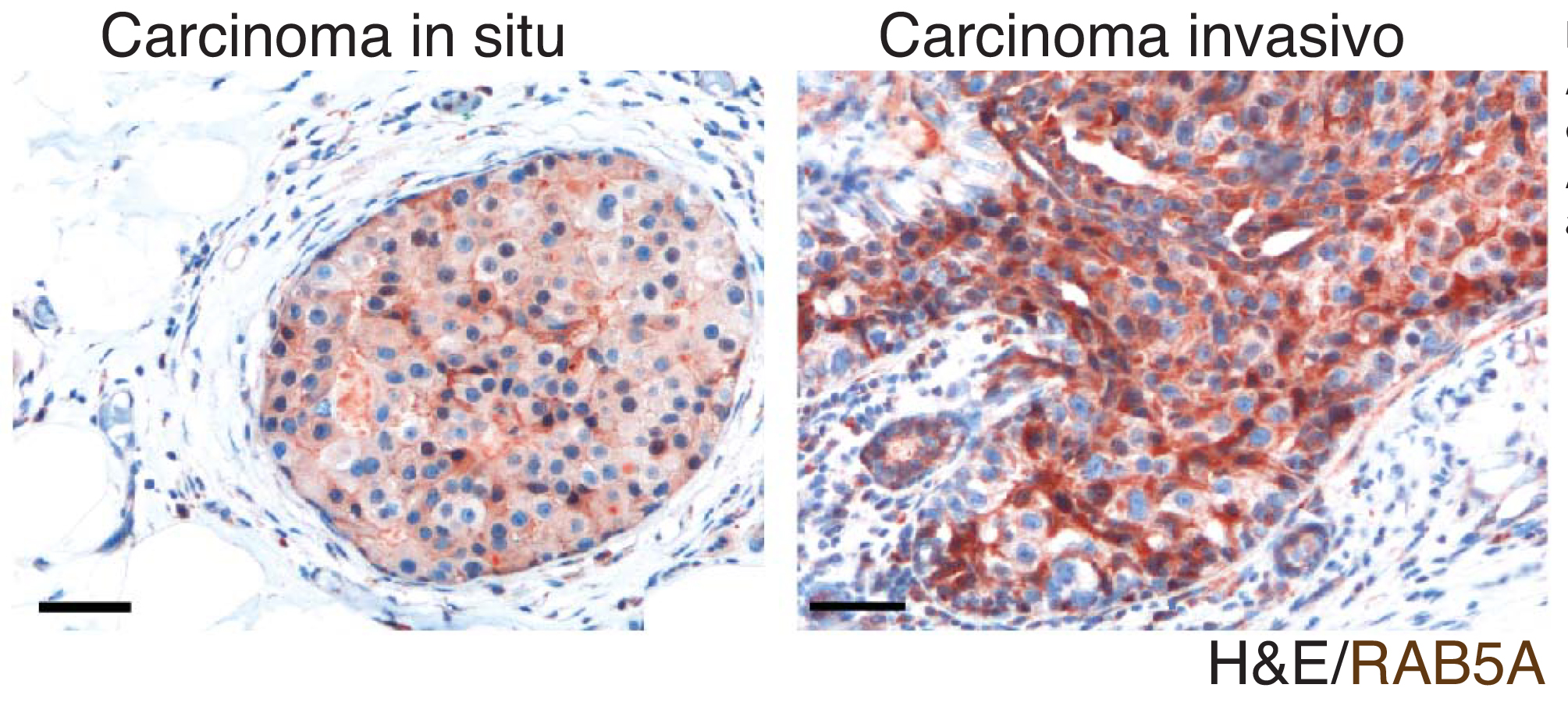 A sinistra un Carcinoma mammario confinato nel dotto mammario (in situ) che esprime bassi livelli (in Marrone) del fattore di fluidificazione RAB5A A destra, un carcinoma mammario diventato invasivo che esprime invece alti livelli del fattore di fluidificazione RAB5A.
A sinistra un Carcinoma mammario confinato nel dotto mammario (in situ) che esprime bassi livelli (in Marrone) del fattore di fluidificazione RAB5A A destra, un carcinoma mammario diventato invasivo che esprime invece alti livelli del fattore di fluidificazione RAB5A.La connessione tra il processo endocitico regolato da Rab5 e la transizione da stato più solido a più fluido è stata approfondita utilizzando un sistema sperimentale costituito da sferoidi tumorali immersi in una matrice di collagene che riproduce il microambiente che tipicamente il nostro organismo sviluppa per limitare la crescita di un tumore” spiega Scita. Sfruttando tecniche di ingegneria genetica, microscopia avanzata e biofisica, le cellule tumorali sono state osservate in diretta per monitorarne le modalità di movimento e la capacità attraverso di esso di modificare la rete di fibre di collagene allo scopo di generare canali e vie di fuga attraverso le quali invadere il resto dell’organismo”.
“In particolare, per studiare le caratteristiche dinamiche del tessuto e allo stesso tempo le forze che gli sferoidi esercitano sulla matrice in 3D – aggiungono il ricercatore Fabio Giavazzi e il professore di Fisica Applicata Roberto Cerbino, dell’Università degli Studi di Milano, cofirmatari con Scita anche dell’articolo del 2017 – abbiamo sviluppato modelli e algoritmi innovativi per l’analisi quantitativa dei filmati acquisiti. Fondamentale è stato l’utilizzo di marcatori fluorescenti che sono stati dispersi nella matrice: è seguendo le loro fluttuazioni che siamo riusciti a ottenere informazioni sulle forze di trazione esercitate dalle masse tumorali sulla matrice stessa”.
I dati prodotti sono stati poi validati in sistemi più complessi, tra cui tessuti umani derivati da pazienti affetti da tumori intraduttali mammari. Grazie alla collaborazione con la Unità di istopatologia di IFOM coordinata dal professor Claudio Tripodo dell’Università di Palermo, questo studio ha confermato che nelle sezioni invasive Rab5A è molto più abbondante, dato questo che consolida ulteriormente la forte correlazione osservata tra l’elevata espressione del fattore endocitico nelle cellule tumorali e l’acquisizione di proprietà invasive da parte delle cellule stesse.
“La prossima sfida – conclude Scita – sarà cercare di capire, attraverso lo studio delle proprietà dinamico-meccaniche, se esiste una correlazione tra la forma della cellula e il suo potenziale invasivo e se è possibile usare queste “firma geometrica e meccanica” per individuare il 30% di quei carcinomi duttali mammari che possono acquisire proprietà invasive. Oggi tutte le pazienti a cui viene diagnosticato il DCIS sono trattate con una terapia che è in genere uguale per tutte e che ha effetti collaterali. La combinazione di marcatori strutturali con quelli molecolari potrebbe essere di fondamentale aiuto nel differenziare i trattamenti e ridurre al minimo indispensabile le terapie applicate”.
I risultati della ricerca sostenuta in particolare da Fondazione AIRC, oltre che da Fondazione Cariplo e dal MIUR, sono pubblicati sull’autorevole rivista scientifica Nature Materials e pongono le basi per terapie più mirate per le pazienti colpite da questa neoplasia.
GIORGIO SCITA - Biologo cellulare esperto delle dinamiche di movimento delle cellule, Giorgio Scita dirige all'IFOM dal 2001 l'unità di ricerca Meccanismi di ricerca delle cellule tumorali e dal 2006 è Professore Associato di Patologia Generale presso la Facoltà di Medicina dell'Università degli Studi di Milano. Allo scienziato sono legati diversi studi che approfondiscono la conoscenza dei meccanismi attraverso i quali una cellula percepisce il mondo esterno e ne traduce i segnali, in risposta ai quali modifica il proprio comportamento, soprattutto quello migratorio. In particolare, a lui si deve la scoperta che ha messo in luce la fondamentale connessione tra la capacità delle cellule tumorali di muoversi, anche con modalità differenti, e un processo cellulare, l'endocitosi, tradizionalmente considerato attivo in tutt'altri eventi cellulari. Autore di oltre 100 pubblicazioni, Scita è tra gli scienziati italiani più produttivi e citati. Vincitore del prestigioso grant advanced ERC (2011) nel 2014 è stato nominato membro dell’EMBO, la prestigiosa Organizzazione Europea per la Biologia Molecolare.
ROBERTO CERBINO - Professore associato di Fisica Applicata presso il Dipartimento BIOMETRA dell'Università degli Studi di Milano. Marie Curie Fellow presso Università di Fribourg (2006), visiting researcher presso Università di Ottawa (2010) visiting professor presso École Normale Supérieure di Lione (2018). Autore di oltre 60 pubblicazioni scientifiche nel campo della fisica dei materiali soffici e biologici, si occupa anche di esperimenti in microgravità nell'ambito di progetti della European Space Agency.
L’ARTICOLO
- TESTATA: Nature Materials
- DATA DI PUBBLICAZIONE: 22 luglio 2019
- TITOLO: Unjamming overcomes kinetic and proliferation arrest in terminally differentiated cells and promotes collective motility of carcinoma
- AUTORI: Andrea Palamidessi, Chiara Malinverno, Emanuela Frittoli, Salvatore Corallino, Elisa Barbieri, Sara Sigismund, Galina V. Beznoussenko, Emanuele Martini, Massimiliano Garre, Ines Ferrara, Claudio Tripodo, Flora Ascione, Elisabetta A. Cavalcanti-Adam, Qingsen Li, Pier Paolo Di Fiore, Dario Parazzoli, Fabio Giavazzi, Roberto Cerbino, Giorgio Scita.
- DOI: 10.1038/s41563-019-0425-1
- Elena Bauer
Responsabile ufficio stampa e comunicazione
IFOM, Istituto FIRC di Oncologia Molecolare, Milano
+39 02/574303821 - +39 3387374364
elena.bauer@ifom.eu - Anna Cavagna
Capo Ufficio Stampa
Università degli Studi di Milano
+ 39 02 50312983 - +39 3346866587
anna.cavagna@unimi.it